近日,青岛大学基础医学院李冰教授团队和生命科学学院许元红教授合作,在《Chemical Engineering Journal》(IF=16.744,中科院1区)发表题为“Right once for all: Zinc-modulated highly stable iron-based ROS generator under physiological conditions for promoting bacteria-infected wound healing”的研究论文(doi.org/10.1016/j.cej.2023.141837)。遗传学硕士研究生钟迪为论文独立第一作者,李冰教授和许元红教授为共同通讯作者,基础医学院为论文第一单位。该研究得到国家自然科学基金、山东省泰山学者青年专家人才工程、山东省高等学校青年创新科技计划等项目的资助。
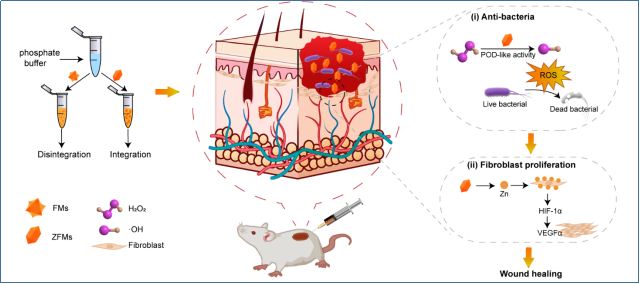
全球每年约有120万人死于耐抗生素细菌感染。临床上,在伤口愈合的第一阶段通常需要高浓度的H2O2灭菌,但这对正常组织会产生不利影响,延迟愈合过程。具有过氧化物酶(POD)样活性的纳米酶可以在低浓度H2O2的存在下产生强大的氧化•OH,攻击细菌生物膜,最终导致细菌死亡。由金属离子和有机配体形成的金属-有机框架(MOFs)具有超高的比表面积、均匀的多孔结构、灵活的功能金属位点和整个框架的有机基团等特点,因此在结构、组成和性能上易于功能化。其中,铁基MOFs(Fe-MOFs)纳米酶可以通过内在的POD样活性产生ROS,并直接导致细胞膜/壁的损伤,因此具有巨大的抑制细菌生长的潜力。
本研究报道了一种微量Zn调控的Fe-MOFs(ZFMs)纳米酶,它被设计为一种稳定和高效的ROS产生装置,以促进细菌感染的伤口愈合。所制备的ZFMs伤口敷料可以保证在生理条件(pH 7.4)下的长期稳定性,同时可以避免金属离子大量释放引起的组织毒性。此外,体外实验证明ZFMs具有良好的POD样活性,微量ZFMs(150 μg mL-1)对产生超广谱β-内酰胺酶(ESBL)的大肠杆菌有98%的致死率。而传统的Fe-MOFs仅在高浓度条件下(>500 μg mL-1)下才有显著的杀菌作用。同时,Zn可以降低FMs的毒性,上调VEGFα的表达,促进成纤维细胞的增殖,该研究为实现伤口的加速愈合和快速消毒提供了新途径。